Každý člověk se během svého života setká s těly, která jsou v jednom ze tří souhrnných stavů hmoty. Nejjednodušší stav agregace ke studiu je plyn. V článku se budeme zabývat konceptem ideálního plynu, uvedeme stavovou rovnici systému a také věnujeme určitou pozornost popisu absolutní teploty.
Skupenství plynu
Každý student má dobrou představu o tom, o jakém stavu hmoty mluví, když slyší slovo „plyn“. Toto slovo je chápáno jako těleso, které je schopno obsadit jakýkoli objem, který je mu poskytnut. Není schopen udržet svůj tvar, protože neodolá ani nejmenším vnějším vlivům. Plyn také neudržuje objem, což jej odlišuje nejen od pevných látek, ale také od kapalin.
Stejně jako kapalina je plyn tekutá látka. V procesu pohybu pevných těles v plynech tento pohyb brzdí. Výsledná síla se nazývá odpor. Jeho hodnota závisí narychlost tělesa v plynu.
Silnými příklady plynů jsou vzduch, zemní plyn používaný k vytápění domácností a vaření, inertní plyny (Ne, Ar) používané k plnění reklamních žhavicích trubic nebo používané k vytvoření inertního (neagresivního, ochranného) prostředí při svařování.
Ideální plyn
Než přistoupíte k popisu plynových zákonů a stavové rovnice, měli byste dobře porozumět otázce, co je ideální plyn. Tento koncept je zaveden v molekulární kinetické teorii (MKT). Ideální plyn je jakýkoli plyn, který splňuje následující vlastnosti:
- Částice, které jej tvoří, spolu neinteragují kromě přímých mechanických srážek.
- V důsledku srážky částic se stěnami nádoby nebo mezi nimi navzájem se zachovává jejich kinetická energie a hybnost, to znamená, že srážka je považována za absolutně elastickou.
- Částice nemají žádné rozměry, ale mají konečnou hmotnost, to znamená, že jsou podobné hmotným bodům.
Je přirozené, že žádný plyn není ideální, ale skutečný. Nicméně pro řešení mnoha praktických problémů jsou tyto aproximace zcela platné a lze je použít. Existuje obecné empirické pravidlo, které říká: bez ohledu na chemickou povahu, pokud má plyn teplotu nad pokojovou teplotou a tlak řádově atmosférický nebo nižší, pak jej lze považovat za ideální s vysokou přesností a lze jej použít k popisu to.vzorec stavové rovnice ideálního plynu.
Zákon Clapeyron-Mendelejev
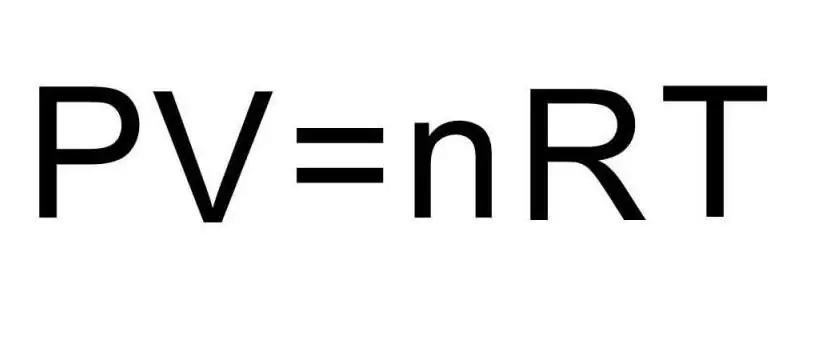
Přechody mezi různými agregovanými stavy hmoty a procesy v rámci jednoho agregovaného stavu jsou řešeny termodynamikou. Tlak, teplota a objem jsou tři veličiny, které jednoznačně definují jakýkoli stav termodynamického systému. Vzorec pro stavovou rovnici ideálního plynu spojuje všechny tři tyto veličiny do jediné rovnosti. Napišme tento vzorec:
PV=nRT
Zde P, V, T - tlak, objem, teplota, resp. Hodnota n je látkové množství v molech a symbol R označuje univerzální konstantu plynů. Tato rovnost ukazuje, že čím větší je součin tlaku a objemu, tím větší musí být součin množství látky a teploty.

Vzorec pro stavovou rovnici plynu se nazývá Clapeyron-Mendělejevův zákon. V roce 1834 francouzský vědec Emile Clapeyron, shrnující experimentální výsledky svých předchůdců, dospěl k této rovnici. Clapeyron však používal řadu konstant, které Mendělejev později nahradil jednou - univerzální plynovou konstantou R (8, 314 J / (molK)). Proto je v moderní fyzice tato rovnice pojmenována podle jmen francouzských a ruských vědců.

Další formuláře rovnic
Výše jsme napsali Mendělejevovu-Clapeyronovu stavovou rovnici pro ideální plyn v obecně uznávaných apohodlná forma. V problémech v termodynamice však může být často vyžadována trochu jiná forma. Níže jsou napsány další tři vzorce, které přímo vyplývají ze zapsané rovnice:
PV=NkBT;
PV=m/MRT;
P=ρRT/M.
Tyto tři rovnice jsou univerzální i pro ideální plyn, jen se v nich objevují takové veličiny jako hmotnost m, molární hmotnost M, hustota ρ a počet částic N, které systém tvoří. Symbol kB zde označuje Boltzmannovu konstantu (1, 3810-23J/K).
Boyle-Mariottův zákon
Když Clapeyron sestavoval svou rovnici, vycházel z plynových zákonů, které byly experimentálně objeveny před několika desetiletími. Jedním z nich je zákon Boyle-Mariotte. Odráží izotermický proces v uzavřeném systému, v jehož důsledku se mění makroskopické parametry jako tlak a objem. Pokud do stavové rovnice pro ideální plyn dáme konstantu T a n, pak zákon o plynu bude mít tvar:
P1V1=P2V 2
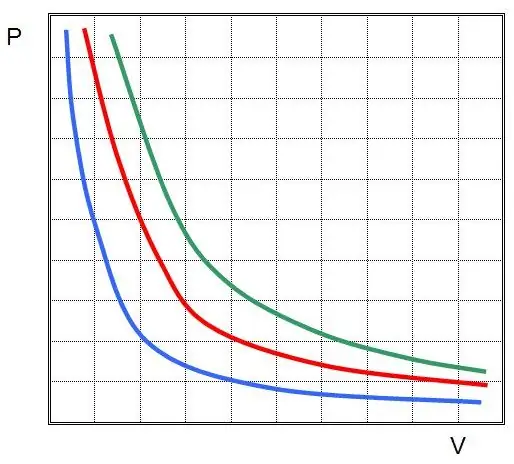
Toto je Boyle-Mariotteův zákon, který říká, že součin tlaku a objemu je zachován během libovolného izotermického procesu. V tomto případě se změní samotné hodnoty P a V.
Pokud vynesete P(V) nebo V(P), pak izotermy budou hyperboly.
Zákony Karla a Gaye-Lussaca
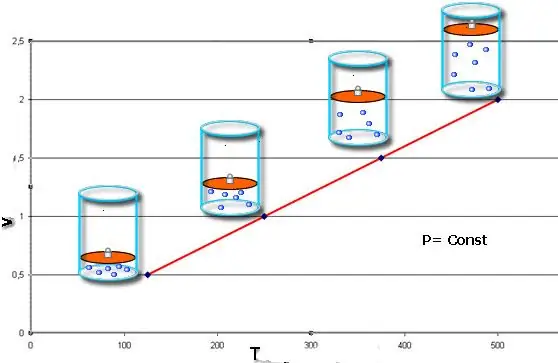
Tyto zákony matematicky popisují izobariku a izochorikuprocesy, tedy takové přechody mezi stavy plynové soustavy, ve kterých jsou zachovány tlak a objem, resp. Charlesův zákon lze matematicky zapsat takto:
V/T=konst, když n, P=konst.
Gay-Lussacův zákon je napsán následovně:
P/T=konst, když n, V=konst.
Pokud jsou obě rovnosti prezentovány ve formě grafu, pak dostaneme rovné čáry, které jsou nakloněny pod určitým úhlem k ose x. Tento typ grafu ukazuje přímou úměrnost mezi objemem a teplotou při konstantním tlaku a mezi tlakem a teplotou při konstantním objemu.
Všimněte si, že všechny tři uvažované zákony o plynu neberou v úvahu chemické složení plynu ani změnu množství hmoty.
Absolutní teplota
V každodenním životě jsme zvyklí používat teplotní stupnici Celsia, protože je vhodná pro popis procesů kolem nás. Voda se tedy vaří při 100 oC a mrzne při 0 oC. Ve fyzice se tato stupnice ukazuje jako nevhodná, proto se používá tzv. stupnice absolutní teploty, kterou zavedl lord Kelvin v polovině 19. století. V souladu s touto stupnicí se teplota měří v Kelvinech (K).
Předpokládá se, že při teplotě -273, 15 oC nedochází k tepelným vibracím atomů a molekul, jejich dopředný pohyb se zcela zastaví. Tato teplota ve stupních Celsia odpovídá absolutní nule v Kelvinech (0 K). Z této definicefyzikální význam absolutní teploty následuje: je to míra kinetické energie částic, které tvoří hmotu, například atomy nebo molekuly.
Kromě výše uvedeného fyzikálního významu absolutní teploty existují i jiné přístupy k pochopení této veličiny. Jedním z nich je zmíněný Karlův plynový zákon. Zapišme to v následujícím tvaru:
V1/T1=V2/T 2=>
V1/V2=T1/T 2.
Poslední rovnost říká, že při určitém množství látky v systému (například 1 mol) a určitém tlaku (například 1 Pa) objem plynu jednoznačně určuje absolutní teplotu. Jinými slovy, zvýšení objemu plynu za těchto podmínek je možné pouze v důsledku zvýšení teploty a snížení objemu indikuje pokles hodnoty T.
Připomeňme, že na rozdíl od teploty ve stupních Celsia nemůže být absolutní teplota záporná.
Princip Avogadro a směsi plynů
Kromě výše uvedených plynových zákonů vede stavová rovnice pro ideální plyn také k principu objevenému Amedeo Avogadro na začátku 19. století, který nese jeho příjmení. Tento princip stanoví, že objem jakéhokoli plynu při konstantním tlaku a teplotě je určen množstvím látky v systému. Odpovídající vzorec vypadá takto:
n/V=konst, když P, T=konst.
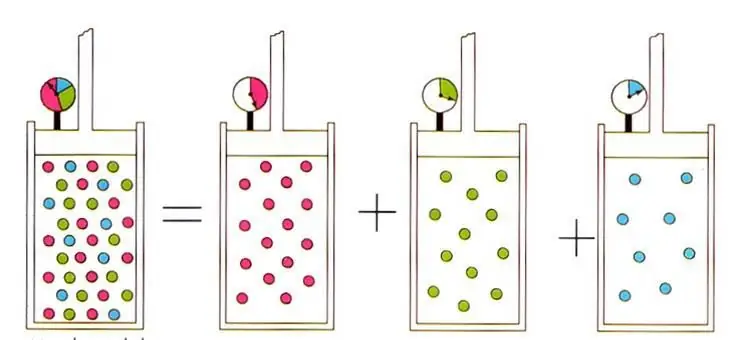
Psaný výraz vede k dobře známému ve fyzice ideálních plynů D altonovu zákonu pro směsi plynů. Tentozákon říká, že parciální tlak plynu ve směsi je jednoznačně určen jeho atomovým zlomkem.
Příklad řešení problému
V uzavřené nádobě s pevnými stěnami obsahující ideální plyn se v důsledku zahřívání zvýšil tlak 3krát. Je nutné určit konečnou teplotu systému, pokud její počáteční hodnota byla 25 oC.
Nejprve převedeme teplotu ze stupňů Celsia na Kelvina, máme:
T=25 + 273, 15=298, 15 K.
Vzhledem k tomu, že stěny nádoby jsou tuhé, lze proces ohřevu považovat za izochorický. V tomto případě použijeme zákon Gay-Lussac, máme:
P1/T1=P2/T 2=>
T2=P2/P1T 1.
Konečná teplota je tedy určena ze součinu tlakového poměru a počáteční teploty. Dosazením dat do rovnosti dostaneme odpověď: T2=894,45 K. Tato teplota odpovídá 621,3 oC.






