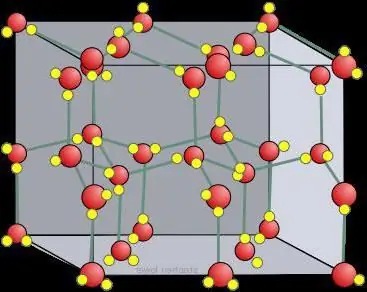
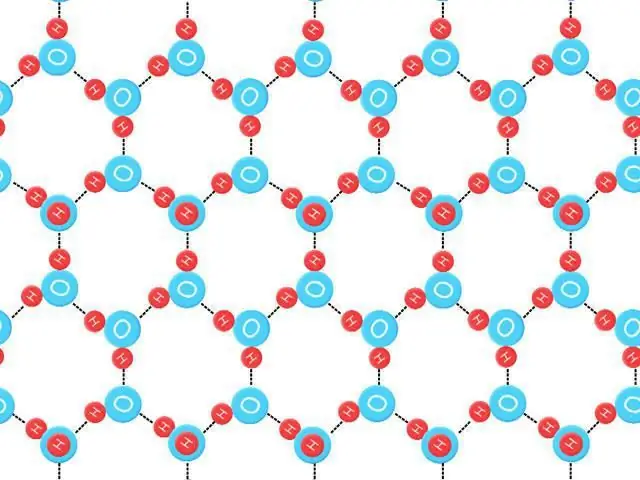
Trojrozměrný stav kapalné vody je obtížné studovat, ale mnoho jsme se naučili analýzou struktury ledových krystalů. Čtyři sousední atomy kyslíku interagující s vodíkem zaujímají vrcholy čtyřstěnu (tetra=čtyři, hedron=rovina). Průměrná energie potřebná k přerušení takové vazby v ledu se odhaduje na 23 kJ/mol-1.

Schopnost molekul vody tvořit daný počet vodíkových řetězců, stejně jako daná síla, vytváří neobvykle vysoký bod tání. Když taje, drží ho kapalná voda, jejíž struktura je nepravidelná. Většina vodíkových vazeb je zkreslená. K rozbití krystalové mřížky ledu s vodíkovou vazbou je potřeba velké množství energie ve formě tepla.
Vlastnosti vzhledu ledu (Ih)
Mnoho obyvatel se diví, jakou má led krystalovou mřížku. NutnéJe třeba poznamenat, že hustota většiny látek se zvyšuje během zmrazování, kdy se molekulární pohyby zpomalují a tvoří se hustě zabalené krystaly. Hustota vody se také zvyšuje, když se ochladí na maximum při 4 °C (277 K). Poté, když teplota klesne pod tuto hodnotu, expanduje.
Toto zvýšení je způsobeno tvorbou otevřeného ledového krystalu s vodíkovou vazbou s jeho mřížkou a nižší hustotou, ve kterém je každá molekula vody pevně vázána výše uvedeným prvkem a čtyřmi dalšími hodnotami, přičemž se pohybuje dostatečně rychle, aby mít větší hmotnost. Protože k této akci dojde, kapalina zamrzne shora dolů. To má důležité biologické výsledky, v důsledku kterých vrstva ledu na jezírku izoluje živé bytosti před extrémním chladem. Kromě toho dvě další vlastnosti vody souvisejí s jejími vodíkovými vlastnostmi: specifické teplo a vypařování.
Podrobný popis struktur
Prvním kritériem je množství potřebné ke zvýšení teploty 1 gramu látky o 1°C. Zvyšování stupňů vody vyžaduje relativně velké množství tepla, protože každá molekula je zapojena do četných vodíkových vazeb, které musí být přerušeny, aby se zvýšila kinetická energie. Mimochodem, hojnost H2O v buňkách a tkáních všech velkých mnohobuněčných organismů znamená, že kolísání teploty uvnitř buněk je minimalizováno. Tato vlastnost je zásadní, protože rychlost většiny biochemických reakcícitlivý.
Výparné teplo vody je také výrazně vyšší než u mnoha jiných kapalin. K přeměně tohoto tělesa na plyn je potřeba velké množství tepla, protože vodíkové vazby se musí přerušit, aby se molekuly vody od sebe oddělily a vstoupily do zmíněné fáze. Proměnlivá tělesa jsou trvalé dipóly a mohou interagovat s jinými podobnými sloučeninami a těmi, které se ionizují a rozpouštějí.
Další výše uvedené látky mohou přijít do kontaktu pouze v případě, že je polarita přítomna. Právě tato sloučenina se podílí na struktuře těchto prvků. Kromě toho se může zarovnat kolem těchto částic vytvořených z elektrolytů, takže záporné atomy kyslíku molekul vody jsou orientovány na kationty a kladné ionty a atomy vodíku jsou orientovány na anionty.
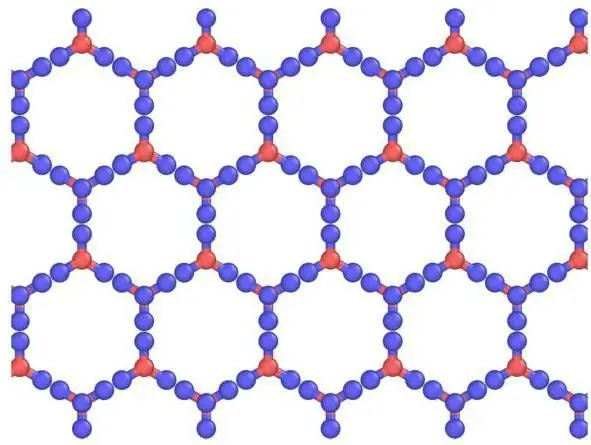
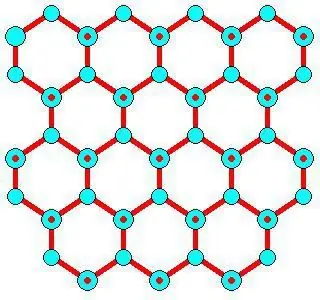
V pevných látkách se zpravidla tvoří molekulární krystalové mřížky a atomové mřížky. To znamená, že pokud je jód postaven tak, že obsahuje I2, , pak v pevném oxidu uhličitém, tedy v suchém ledu, jsou molekuly CO2 umístěné v uzlech krystalové mřížky . Při interakci s podobnými látkami má led iontovou krystalovou mřížku. Například grafit, který má atomovou strukturu založenou na uhlíku, ji nedokáže změnit, stejně jako diamant.
Co se stane, když se krystal kuchyňské soli rozpustí ve vodě: polární molekuly jsou přitahovány k nabitým prvkům v krystalu, což vede k vytvoření podobných částic sodíku a chloridu na jeho povrchu, což má za následek vznik těchto tělesse od sebe oddalují a začíná se rozpouštět. Odtud lze pozorovat, že led má krystalovou mřížku s iontovou vazbou. Každý rozpuštěný Na + přitahuje negativní konce několika molekul vody, zatímco každý rozpuštěný Cl - přitahuje pozitivní konce. Skořápka obklopující každý iont se nazývá úniková koule a obvykle obsahuje několik vrstev částic rozpouštědla.
Mřížka krystalů suchého ledu
Proměnné nebo iont obklopený prvky jsou považovány za sulfatované. Když je rozpouštědlem voda, jsou takové částice hydratované. Každá polární molekula má tedy tendenci být solvatována prvky kapalného tělesa. V suchém ledu tvoří typ krystalové mřížky ve stavu agregace atomové vazby, které se nemění. Další věcí je krystalický led (zmrzlá voda). Iontové organické sloučeniny, jako je karboxyláza a protonované aminy, musí být rozpustné v hydroxylových a karbonylových skupinách. Částice obsažené v takových strukturách se pohybují mezi molekulami a jejich polární systémy tvoří vodíkové vazby s tímto tělesem.
Počet posledně uvedených skupin v molekule samozřejmě ovlivňuje její rozpustnost, která také závisí na reakci různých struktur v prvku: například jedno-, dvou- a tříuhlíkové alkoholy jsou mísitelné s vodou, ale větší uhlovodíky s jednoduchými hydroxylovými sloučeninami jsou v kapalinách mnohem méně zředěné.
Šestihranný Ih má podobný tvar jakoatomová krystalová mřížka. U ledu a veškerého přírodního sněhu na Zemi to vypadá přesně takto. Svědčí o tom symetrie krystalické mřížky ledu, vyrostlé z vodní páry (tedy sněhových vloček). Je v kosmické skupině P 63/mm od 194; D 6h, třída Laue 6/mm; podobný β-, který má násobek 6 spirálové osy (rotace kolem a posun podél ní). Má poměrně otevřenou strukturu s nízkou hustotou, kde je účinnost nízká (~ 1/3) ve srovnání s jednoduchými krychlovými (~ 1/2) nebo krychlovými strukturami s plošným středem (~ 3/4).
Ve srovnání s obyčejným ledem je krystalická mřížka suchého ledu, vázaná molekulami CO2, statická a mění se pouze při rozpadu atomů.
Popis mřížek a jejich prvků
Krystaly lze považovat za krystalické modely skládající se z listů umístěných nad sebou. Vodíková vazba je uspořádaná, zatímco ve skutečnosti je náhodná, protože protony se mohou pohybovat mezi molekulami vody (ledu) při teplotách nad asi 5 K. Je skutečně pravděpodobné, že se protony chovají jako kvantová tekutina v konstantním tunelovém toku. To je zesíleno rozptylem neutronů, který ukazuje jejich hustotu rozptylu uprostřed mezi atomy kyslíku, což naznačuje lokalizaci a koordinovaný pohyb. Zde je podobnost ledu s atomovou, molekulární krystalovou mřížkou.
Molekuly mají rozložené uspořádání vodíkového řetězcevzhledem ke svým třem sousedům v letadle. Čtvrtý prvek má uspořádání zatmělých vodíkových vazeb. Je zde mírná odchylka od dokonalé hexagonální symetrie, protože základní buňka je o 0,3 % kratší ve směru tohoto řetězce. Všechny molekuly zažívají stejná molekulární prostředí. Uvnitř každé "krabice" je dostatek prostoru pro uložení částeček intersticiální vody. Ačkoli se o nich obecně neuvažuje, byly nedávno účinně detekovány neutronovou difrakcí práškové krystalové mřížky ledu.
Changing Substances
Šestihranné těleso má trojité body s kapalnou a plynnou vodou 0,01 °C, 612 Pa, pevné prvky - tři -21,985 °C, 209,9 MPa, jedenáct a dva -199,8 °C, 70 MPa, stejně jako - 34,7 °C, 212,9 MPa. Dielektrická konstanta hexagonálního ledu je 97,5.
Křivka tání tohoto prvku je dána MPa. Stavové rovnice jsou k dispozici, kromě nich i některé jednoduché nerovnice vztahující se ke změně fyzikálních vlastností k teplotě hexagonálního ledu a jeho vodných suspenzí. Tvrdost kolísá se stupni stoupajícími od nebo pod sádrovce (≦2) při 0 °C až po živec (6 Mohs) při -80 °C, což je abnormálně velká změna absolutní tvrdosti (> 24krát).
Šestihranná krystalová mřížka ledu tvoří šestiúhelníkové desky a sloupce, kde horní a spodní strana jsou bazální roviny {0 0 0 1} s entalpií 5,57 μJ cm -2a další ekvivalentní boční části se nazývají části hranolu {1 0 -1 0} s 5, 94µJ cm -2. Sekundární povrchy {1 1 -2 0} s 6,90 ΜJ ˣ cm -2 mohou být vytvořeny podél rovin tvořených stranami konstrukcí.
Taková struktura vykazuje anomální pokles tepelné vodivosti s rostoucím tlakem (stejně jako krychlový a amorfní led nízké hustoty), ale liší se od většiny krystalů. To je způsobeno změnou vodíkové vazby, která snižuje příčnou rychlost zvuku v krystalové mřížce ledu a vody.
Existují metody popisující, jak připravit vzorky velkých krystalů a jakýkoli požadovaný ledový povrch. Předpokládá se, že vodíková vazba na povrchu zkoumaného šestiúhelníkového tělesa bude uspořádanější než uvnitř hromadného systému. Variační spektroskopie s generováním frekvence s fázovou mřížkou ukázala, že existuje strukturální asymetrie mezi dvěma horními vrstvami (L1 a L2) v podpovrchovém HO řetězci bazálního povrchu hexagonálního ledu. Přijaté vodíkové vazby v horních vrstvách šestiúhelníků (L1 O ··· HO L2) jsou silnější než ty, které jsou přijaty ve druhé vrstvě k horní akumulaci (L1 OH ··· O L2). K dispozici jsou interaktivní šestihranné ledové struktury.
Vývojové funkce
Minimální počet molekul vody potřebných k vytvoření ledu je přibližně 275 ± 25, stejně jako u úplného ikosaedrického shluku 280. K tvorbě dochází rychlostí 10 10 při rozhraní vzduch-voda a ne ve velké vodě. Růst ledových krystalů závisí na různých rychlostech růstu různýchenergií. Voda musí být chráněna před zamrznutím při kryoprezervaci biologických vzorků, potravin a orgánů.
Toho je typicky dosaženo rychlými rychlostmi chlazení, použitím malých vzorků a kryokonzervátoru a zvýšením tlaku na nukleaci ledu a zabránění poškození buněk. Volná energie ledu/kapaliny se zvyšuje z ~30 mJ/m2 při atmosférickém tlaku na 40 mJ/m-2 při 200 MPa, což ukazuje důvod, proč k tomuto efektu dochází.
Jaký typ krystalové mřížky je charakteristický pro led
Alternativně mohou růst rychleji z povrchů hranolů (S2), na náhodně narušeném povrchu rychle zamrzlých nebo rozbouřených jezer. Růst z ploch {1 1 -2 0} je přinejmenším stejný, ale mění je na základny hranolů. Údaje o vývoji ledového krystalu byly plně prozkoumány. Relativní rychlosti růstu prvků různých tváří závisí na schopnosti vytvářet velký stupeň hydratace kloubu. Teplota (nízká) okolní vody určuje stupeň rozvětvení v ledovém krystalu. Růst částic je omezen rychlostí difúze při nízkém stupni podchlazení, tj. <2 °C, což má za následek více z nich.

Omezeno kinetikou vývoje při vyšších úrovních deprese >4°C, což vede k růstu jehly. Tento tvar je podobný struktuře suchého ledu (má krystalovou mřížku s hexagonální strukturou), různýcharakteristika vývoje povrchu a teplota okolní (podchlazené) vody, která stojí za plochými tvary sněhových vloček.
Tvorba ledu v atmosféře hluboce ovlivňuje tvorbu a vlastnosti mraků. Živce, které se nacházejí v pouštním prachu, který vstupuje do atmosféry v milionech tun ročně, jsou důležitými formovateli. Počítačové simulace ukázaly, že je to způsobeno nukleací prizmatických ledových krystalických rovin na vysokoenergetických povrchových rovinách.
Některé další prvky a mřížky
Rozpuštěné látky (s výjimkou velmi malého hélia a vodíku, které mohou vstupovat do mezer) nemohou být za atmosférického tlaku zahrnuty do struktury Ih, ale jsou vytlačovány na povrch nebo do amorfní vrstvy mezi částicemi mikrokrystalické tělo. Na místech mřížky suchého ledu jsou některé další prvky: chaotropní ionty jako NH4 + a Cl -, které jsou součástí lehčího zmrazování kapalin než ostatní kosmotropní zmrazování, jako je Na + a SO42-, takže jejich odstranění není možné vzhledem k tomu, že tvoří tenký film zbývající kapaliny mezi krystaly. To může vést k elektrickému nabití povrchu v důsledku disociace povrchové vody vyrovnávající zbývající náboje (což může také vést k magnetickému záření) a ke změně pH zbytkových kapalných filmů, např. NH 42SO4 se stává kyselejším a NaCl se stává zásaditější.
Jsou kolmé k plochámkrystalová mřížka ledu zobrazující další připojenou vrstvu (s atomy O černě). Vyznačují se pomalu rostoucím bazálním povrchem {0 0 0 1}, kde jsou připojeny pouze izolované molekuly vody. Rychle rostoucí {1 0 -1 0} povrch hranolu, kde se páry nově připojených částic mohou vzájemně vázat vodíkem (jedna vodíková vazba/dvě molekuly prvku). Nejrychleji rostoucí plocha je {1 1 -2 0} (sekundární prizmatický), kde mohou řetězce nově připojených částic vzájemně interagovat vodíkovou vazbou. Jeden z jejích řetězců/molekul prvku je forma, která tvoří hřebeny, které rozdělují a podporují transformaci na dvě strany hranolu.
Entropie nulového bodu
Lze definovat jako S 0=k B ˣ Ln (N E0), kde k B je Boltzmannova konstanta, NE je počet konfigurací na energii E a E0 je nejnižší energie. Tato hodnota pro entropii hexagonálního ledu při nule Kelvinů neporušuje třetí zákon termodynamiky „Entropie ideálního krystalu při absolutní nule je přesně nula“, protože tyto prvky a částice nejsou ideální, mají neuspořádané vodíkové vazby.
V tomto tělese je vodíková vazba náhodná a rychle se mění. Tyto struktury nejsou přesně energeticky stejné, ale rozšiřují se do velmi velkého počtu energeticky blízkých stavů, podléhají "pravidlům ledu". Entropie nulového bodu je porucha, která by zůstala zachována, i kdyby bylo možné materiál ochladit na absolutní hodnotunula (0 K=-273, 15 °C). Vytváří experimentální zmatek pro šestiúhelníkový led 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoreticky by bylo možné vypočítat nulovou entropii známých ledových krystalů s mnohem větší přesností (zanedbání defektů a šíření energetické hladiny), než ji určit experimentálně.
Vědci a jejich práce v této oblasti
Lze definovat jako S 0=k B ˣ Ln (N E0), kde k B je Boltzmannova konstanta, NE je počet konfigurací na energii E a E0 je nejnižší energie. Tato hodnota pro entropii hexagonálního ledu při nule Kelvinů neporušuje třetí zákon termodynamiky „Entropie ideálního krystalu při absolutní nule je přesně nula“, protože tyto prvky a částice nejsou ideální, mají neuspořádané vodíkové vazby.
V tomto tělese je vodíková vazba náhodná a rychle se mění. Tyto struktury nejsou přesně energeticky stejné, ale rozšiřují se do velmi velkého počtu energeticky blízkých stavů, podléhají "pravidlům ledu". Entropie nulového bodu je porucha, která by zůstala zachována, i kdyby bylo možné materiál ochladit na absolutní nulu (0 K=-273,15 °C). Vytváří experimentální zmatek pro šestiúhelníkový led 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoreticky by bylo možné vypočítat nulovou entropii známých ledových krystalů s mnohem větší přesností (zanedbání defektů a šíření energetické hladiny), než ji určit experimentálně.

Přestože pořadí protonů ve velkém ledu není uspořádáno, povrch pravděpodobně preferuje pořadí těchto částic ve formě pásů zavěšených atomů H a O-single párů (nulová entropie s uspořádanými vodíkovými vazbami). Je nalezena porucha nulového bodu ZPE, J ˣ mol -1 ˣ K -1 a další. Ze všeho výše uvedeného je jasné a srozumitelné, jaké typy krystalových mřížek jsou charakteristické pro led.






