V naší době se fyzika stala velmi běžnou vědou. Je přítomen doslova všude. Nejelementárnější příklad: na vašem dvoře roste jabloň a dozrává na ní ovoce, přijde čas a jablka začnou padat, ale jakým směrem padají? Díky zákonu univerzální gravitace náš plod padá k zemi, tedy klesá, ale ne nahoru. Byl to jeden z nejznámějších příkladů fyziky, ale věnujme pozornost termodynamice, přesněji řečeno fázovým rovnováhám, které jsou v našem životě neméně důležité.
Termodynamika

Nejprve se podívejme na tento termín. ΘερΜοδυναΜική - takto vypadá slovo v řečtině. První část ΘερΜo znamená „teplo“a druhá δυναΜική znamená „síla“. Termodynamika je obor fyziky, který studuje vlastnosti makroskopického systému a také různé způsoby přeměny a přenosu energie. V této části jsou speciálně studovány různé stavy a procesy, aby bylo možné do popisu zavést pojem teploty (jedná se o fyzikální veličinu, která charakterizuje termodynamický systém a měří se pomocíněkteré spotřebiče). Všechny probíhající procesy v termodynamických systémech jsou popsány pouze mikroskopickými veličinami (tlak a teplota, stejně jako koncentrace složek).
Clapeyron-Clausiusova rovnice
Tuto rovnici zná každý fyzik, ale pojďme si ji rozebrat kousek po kousku. Odkazuje na rovnovážné procesy přechodu určité hmoty z jedné fáze do druhé. To je jasně vidět na takových příkladech: tavení, odpařování, sublimace (jeden ze způsobů konzervace produktů, který probíhá úplným odstraněním vlhkosti). Vzorec jasně ukazuje probíhající procesy:
- n=PV/RT;
- kde T je teplota látky;
- P-tlak;
- R-specifické teplo fázového přechodu;
- V-změna konkrétního objemu.
Historie vytvoření rovnice

Clasiusova-Clapeyronova rovnice je vynikajícím matematickým vysvětlením druhého zákona termodynamiky. Také označovaná jako „Clausiova nerovnost“. Větu přirozeně vyvinul sám vědec, který chtěl vysvětlit vztah mezi tepelným tokem v systému a entropií a také jeho prostředím. Tuto rovnici vyvinul Clausius ve svých pokusech vysvětlit a kvantifikovat entropii. V doslovném smyslu nám věta dává příležitost určit, zda je cyklický proces vratný nebo nevratný. Tato nerovnost nám nabízí kvantitativní vzorec pro pochopení druhého zákona.
Vědec byl jedním z prvních, kdo pracoval na myšlence entropie, a dokonce ji dalnázev procesu. To, co je dnes známé jako Clausiova věta, bylo poprvé publikováno v roce 1862 v Rudolfově šestém díle O použití věty o ekvivalenci transformace pro vnitřní práci. Vědec se pokusil ukázat proporcionální vztah mezi entropií a tokem energie zahříváním (δ Q) v systému. Ve stavebnictví lze tuto tepelnou energii přeměnit na práci a cyklickým procesem ji přeměnit na teplo. Rudolph dokázal, že „algebraický součet všech transformací vyskytujících se v cyklickém procesu může být pouze menší než nula nebo v extrémních případech roven nule.“
Uzavřený izolovaný systém
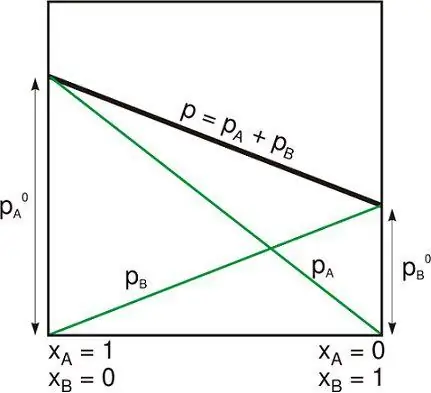
Izolovaný systém je jeden z následujících:
- Fyzický systém je daleko od ostatních, které s nimi neinteragují.
- Termodynamický systém je uzavřen pevnými nepohyblivými stěnami, kterými nemůže projít hmota ani energie.
Navzdory skutečnosti, že subjekt je vnitřně spjat se svou vlastní gravitací, izolovaný systém se obvykle dostává za hranice vnějších gravitačních a jiných vzdálených sil.
To může být v kontrastu s tím, co se (v obecnější terminologii používané v termodynamice) nazývá uzavřený systém obklopený selektivními stěnami, přes které může být přenášena energie ve formě tepla nebo práce, ale ne hmoty. A s otevřeným systémem, do kterého hmota a energie vstupuje nebo vystupuje, i když v něm mohou být různé neprostupné stěnyčásti jeho hranic.
Izolovaný systém se řídí zákonem zachování. Nejčastěji v termodynamice jsou hmota a energie považovány za samostatné pojmy.
Termodynamické přechody
Pro pochopení kvantových fázových přechodů je užitečné je porovnat s klasickými transformacemi (také nazývanými tepelné inverze). CPT popisuje vrchol termodynamických vlastností systému. Signalizuje reorganizaci částic. Typickým příkladem je mrazový přechod vody, který popisuje plynulý přechod mezi kapalinou a pevnou látkou. Klasické fázové růsty jsou způsobeny soutěží mezi energií systému a entropií jeho tepelných fluktuací.
Klasický systém nemá při nulové teplotě žádnou entropii, a proto nemůže nastat žádná fázová transformace. Jejich řád je určen první nespojitou derivací termodynamického potenciálu. A samozřejmě má první řád. Fázové přeměny z feromagnetu na paramagnet jsou spojité a druhého řádu. Tyto konstantní změny z uspořádané do neuspořádané fáze jsou popsány parametrem řádu, který je nulový. Pro výše uvedenou feromagnetickou transformaci bude parametrem objednávky celková magnetizace systému.
Gibbsův potenciál
Gibbs Free Energy je maximální množství práce bez expanze, kterou lze odstranit z termodynamického uzavřeného systému (který dokáže vyměňovat teplo a pracovat s okolím). Takovýmaximálního výsledku lze dosáhnout pouze při zcela reverzibilním procesu. Když se systém transformuje zpět z prvního stavu do druhého, snížení Gibbsovy volné energie se rovná snížení, které provádí systém ve svém prostředí, mínus práce tlakových sil.
Stav rovnováhy

Termodynamická a mechanická rovnováha je axiomatický koncept termodynamiky. Jedná se o vnitřní stav jednoho nebo více systémů, které jsou propojeny více či méně propustnými nebo nepropustnými stěnami. V tomto stavu neexistují žádné čisté makroskopické toky hmoty nebo energie, ani uvnitř systému, ani mezi systémy.
V jeho vlastním pojetí stavu vnitřní rovnováhy k makroskopické změně nedochází. Soustavy jsou současně ve vzájemné tepelné, mechanické, chemické (konstantní), radiační rovnováze. Mohou být ve stejné podobě. V tomto procesu jsou všechny pohledy uloženy najednou a na dobu neurčitou, dokud není fyzická operace přerušena. V makroskopické rovnováze probíhají dokonale přesné vyvážené výměny. Výše uvedený důkaz je fyzickým vysvětlením tohoto konceptu.
Základy
Každý zákon, věta, formule má svůj vlastní základ. Podívejme se na 3 základy zákona fázové rovnováhy.
- Fáze je forma hmoty, homogenní co do chemického složení, fyzikálního stavu a mechanické rovnováhy. Typické fáze jsou pevná, kapalná a plynná. Dvě nemísitelné kapaliny (nebo kapalné směsi s různým složením) oddělené samostatnou hranicí jsou považovány za dvě odlišné fáze a nemísitelné pevné látky.
- Počet součástí (C) je počet chemicky nezávislých součástí systému. Minimální počet nezávislých druhů potřebný k určení složení všech fází systému.
- Počet stupňů volnosti (F) v tomto kontextu je počet intenzivních proměnných, které jsou na sobě nezávislé.
Klasifikace podle fázových rovnováh
- Reakce kontinuálního čistého přenosu (často nazývané reakce v pevném stavu) se vyskytují mezi pevnou látkou různého složení. Mohou zahrnovat prvky nacházející se v kapalinách (H, C), ale tyto prvky jsou zadržovány v pevných fázích, takže žádné kapalné fáze nejsou zapojeny jako reaktanty nebo produkty (H2O, CO2). Pevné čisté přenosové reakce mohou být kontinuální nebo diskontinuální nebo terminální.
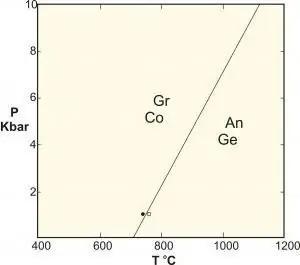
- Polymorfní jsou speciálním typem reakce na pevné fázi, která zahrnuje fáze identického složení. Klasickými příklady jsou reakce mezi hlinitokřemičitany kyanit-sillimanit-andalusit, přeměna grafitu na diamant při vysokém tlaku a rovnováha uhličitanu vápenatého.
Zákony rovnováhy

Pravidlo Gibbsovy továrny navrhl Josiah Willard Gibbs ve svém slavném článku nazvaném „The Equilibrium of Heterogeneous Substances“, který vycházel v letech 1875 až 1878. Platí pronereaktivní vícesložkové heterogenní systémy v termodynamické rovnováze a je daná rovnost:
- F=C-P+2;
- kde F je počet stupňů volnosti;
- C - počet součástí;
- P - počet fází ve vzájemné termodynamické rovnováze.
Počet stupňů volnosti je počet neobsazených intenzivních proměnných. Největší počet termodynamických parametrů, jako je teplota nebo tlak, které se mohou měnit současně a libovolně, aniž by se navzájem ovlivňovaly. Příkladem jednosložkového systému je systém s jednou čistou chemickou látkou, zatímco dvousložkové systémy, jako jsou směsi vody a ethanolu, mají dvě nezávislé složky. Typické fázové přechody (fázová rovnováha) jsou pevné látky, kapaliny, plyny.
Pravidlo fáze při konstantním tlaku
Pro aplikace v materiálové vědě zabývající se fázovými změnami mezi různými pevnými strukturami se často vyskytuje konstantní tlak (např. jedna atmosféra) a je ignorován jako stupeň volnosti, takže pravidlo zní: F=C - P + 1.
Tento vzorec je někdy uváděn pod názvem „pravidlo kondenzované fáze“, ale jak víme, není použitelný pro tyto systémy, které jsou vystaveny vysokým tlakům (například v geologii), protože důsledky těchto tlaky mohou způsobit katastrofální následky.
Může se zdát, že fázová rovnováha je jen prázdná fráze a existuje jen málo fyzikálních procesů, ve kterých tento okamžikje zapojena, ale jak jsme viděli, bez ní mnoho zákonů, které známe, nefunguje, takže se musíte s těmito jedinečnými, barevnými, i když trochu nudnými pravidly trochu seznámit. Tato znalost pomohla mnoha lidem. Naučili se, jak je aplikovat na sebe, například elektrikáři, kteří znají pravidla pro práci s fázemi, se mohou chránit před zbytečným nebezpečím.






