Termodynamika je důležité odvětví fyziky. Můžeme s jistotou říci, že jeho úspěchy vedly ke vzniku technologické éry a do značné míry určovaly běh lidských dějin za posledních 300 let. Článek pojednává o prvním, druhém a třetím zákoně termodynamiky a jejich aplikaci v praxi.
Co je termodynamika?
Než formulujeme zákony termodynamiky, pojďme zjistit, co tato část fyziky dělá.
Slovo „termodynamika“je řeckého původu a znamená „pohyb způsobený teplem“. To znamená, že toto odvětví fyziky se zabývá studiem jakýchkoli procesů, v jejichž důsledku se tepelná energie přeměňuje na mechanický pohyb a naopak.
Základní zákony termodynamiky byly formulovány v polovině 19. století. Věda o „pohybu a teplu“zvažuje chování celého systému jako celku, studuje změnu jeho makroskopických parametrů - teploty, tlaku a objemu, a nevěnuje pozornost jeho mikroskopické struktuře. První z nich navíc hraje zásadní roli při formulaci zákonůtermodynamika ve fyzice. Je zvláštní poznamenat, že jsou odvozeny výhradně z experimentálních pozorování.
Koncept termodynamického systému

To znamená jakoukoli skupinu atomů, molekul nebo jiných prvků, které jsou považovány za celek. Všechny tři zákony jsou formulovány pro tzv. termodynamický systém. Příklady jsou: atmosféra Země, jakýkoli živý organismus, směs plynů ve spalovacím motoru atd.
Všechny systémy v termodynamice patří do jednoho ze tří typů:
- Otevřeno. Vyměňují si teplo i hmotu s prostředím. Například, pokud se jídlo vaří v hrnci na otevřeném ohni, pak je to názorný příklad otevřeného systému, protože hrnec přijímá energii z vnějšího prostředí (oheň), zatímco sám vyzařuje energii ve formě tepla, a také se z něj odpařuje voda (metabolismus).
- Zavřeno. V takových systémech nedochází k výměně hmoty s prostředím, ačkoli k výměně energie dochází. Vraťme se k předchozímu případu: pokud konvici přikryjete víkem, můžete získat uzavřený systém.
- Ojedinělý. Jedná se o druh termodynamických systémů, které si nevyměňují hmotu ani energii s okolním prostorem. Příkladem může být termoska obsahující horký čaj.
Termodynamická teplota

Tento pojem znamená kinetickou energii částic, které tvoří okolní tělesa, která odráží rychlostnáhodný pohyb částic. Čím větší je, tím vyšší je teplota. V souladu s tím, snížením kinetické energie systému, jej ochladíme.
Tento pojem znamená kinetickou energii částic, které tvoří okolní tělesa, která odráží rychlost chaotického pohybu částic. Čím větší je, tím vyšší je teplota. V souladu s tím, snížením kinetické energie systému, jej ochladíme.
Termodynamická teplota je vyjádřena v SI (International System of Units) v Kelvinech (na počest britského vědce Williama Kelvina, který tuto stupnici jako první navrhl). Pochopení prvního, druhého a třetího zákona termodynamiky je nemožné bez definice teploty.
Dělení jednoho stupně na Kelvinově stupnici také odpovídá jednomu stupni Celsia. Převod mezi těmito jednotkami se provádí podle vzorce: TK =TC + 273, 15, kde TK a TC - teploty v kelvinech a stupních Celsia.
Zvláštností Kelvinovy stupnice je, že nemá záporné hodnoty. Nula v něm (TC=-273, 15 oC) odpovídá stavu, kdy tepelný pohyb částic systému zcela chybí, zdá se, že jsou „zmrazené“.
Zachování energie a 1. termodynamický zákon

V roce 1824 učinil Nicolas Léonard Sadi Carnot, francouzský inženýr a fyzik, odvážný návrh, který nejen vedl k rozvoji fyziky, ale stal se také významným krokem ve zlepšení technologie. Jeholze formulovat následovně: "Energie nelze vytvořit ani zničit, lze ji pouze přenést z jednoho stavu do druhého."
Fráze Sadiho Carnota ve skutečnosti postuluje zákon zachování energie, který tvořil základ 1. zákona termodynamiky: „Kdykoli systém přijímá energii zvenčí, přeměňuje ji na jiné formy, hlavní které jsou tepelné a mechanické."
Matematický vzorec pro 1. zákon je napsán takto:
Q=ΔU + A, zde Q je množství tepla přeneseného prostředím do systému, ΔU je změna vnitřní energie tohoto systému, A je dokonalá mechanická práce.
Adiabatické procesy
Dobrým příkladem je pohyb vzdušných mas po horských svazích. Takové hmoty jsou obrovské (kilometrů nebo více) a vzduch je vynikající tepelný izolátor. Zaznamenané vlastnosti nám umožňují považovat jakékoli procesy se vzduchovými hmotami, které probíhají během krátké doby, za adiabatické. Když vzduch stoupá po horském svahu, jeho tlak klesá, expanduje, tedy vykonává mechanickou práci, a v důsledku toho se ochlazuje. Naopak pohyb vzduchové hmoty směrem dolů je doprovázen zvýšením tlaku v ní, stlačuje se a díky tomu se velmi zahřívá.
Uplatnění termodynamického zákona, o kterém jsme hovořili v předchozím podtitulu, lze nejsnáze demonstrovat na příkladu adiabatického procesu.
Podle definice v důsledku toho nedochází k výměně energie sprostředí, to znamená ve výše uvedené rovnici Q=0. To vede k následujícímu výrazu: ΔU=-A. Znaménko mínus zde znamená, že systém vykonává mechanickou práci snížením své vlastní vnitřní energie. Je třeba připomenout, že vnitřní energie je přímo závislá na teplotě systému.
Směr tepelných procesů
Toto číslo se zabývá 2. větou termodynamiky. Každý si jistě všiml, že když přivedete do styku dva předměty s různou teplotou, tak se studený vždy zahřeje a horký ochladí. Všimněte si, že opačný proces může nastat v rámci prvního zákona termodynamiky, ale nikdy není v praxi implementován.
Důvodem nevratnosti tohoto procesu (a všech známých procesů ve Vesmíru) je přechod systému do pravděpodobnějšího stavu. V uvažovaném příkladu s kontaktem dvou těles různých teplot bude nejpravděpodobnější stav, kdy všechny částice systému budou mít stejnou kinetickou energii.
Druhý termodynamický zákon lze formulovat takto: "Teplo se nikdy nemůže samovolně přenést z chladného tělesa na horké." Zavedeme-li pojem entropie jako míru neuspořádanosti, lze jej znázornit takto: „Jakýkoli termodynamický proces probíhá s nárůstem entropie“.
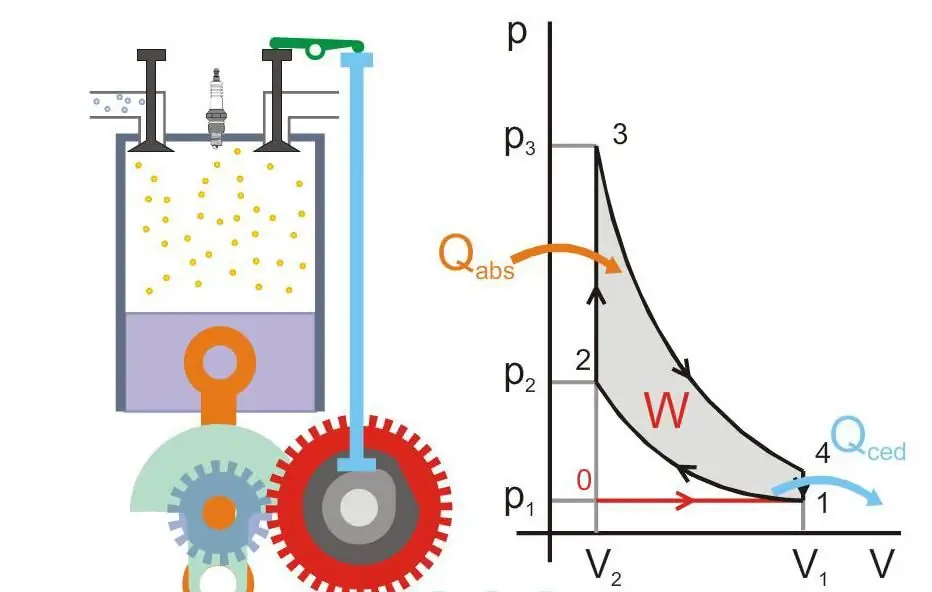
Tepelný motor

Tento termín je chápán jako systém, který díky dodávce vnější energie do něj může vykonávat mechanickou práci. za prvétepelné motory byly parní stroje a byly vynalezeny na konci 17. století.
Při určování jejich účinnosti hraje rozhodující roli druhý termodynamický zákon. Sadi Carnot také zjistil, že maximální účinnost tohoto zařízení je: Účinnost=(T2 - T1)/T2, zde T2 a T1 jsou teploty ohřívače a chladničky. Mechanickou práci lze vykonávat pouze tehdy, když dochází k toku tepla z horkého těla do studeného a tento tok nelze 100% přeměnit na užitečnou energii.
Na obrázku níže je znázorněn princip činnosti tepelného motoru (Qabs - teplo přenášené do stroje, Qced - tepelné ztráty, W - užitečná práce, P a V - tlak a objem plynu v pístu).
Absolutní nula a Nernstův postulát
Nakonec přejděme k úvahám o třetím termodynamickém zákonu. Říká se mu také Nernstův postulát (jméno německého fyzika, který jej poprvé formuloval na počátku 20. století). Zákon říká: "Absolutní nuly nelze dosáhnout konečným počtem procesů." To znamená, že je nemožné jakýmkoli způsobem zcela „zmrazit“molekuly a atomy látky. Důvodem je neustálá výměna tepla s okolím.

Jeden užitečný závěr vyvozený ze třetího zákona termodynamiky je ten, že entropie klesá, když se člověk pohybuje směrem k absolutní nule. To znamená, že systém má tendenci se organizovat sám. Tato skutečnost můžepoužít například k převedení paramagnetů do feromagnetického stavu při ochlazení.
Je zajímavé poznamenat, že nejnižší teplota, které bylo dosud dosaženo, je 5·10−10 K (2003, laboratoř MIT, USA).






